Prof. Dr. Lutz Heinemann
Innovative diagnostische und therapeutische Ansätze
Für jede moderne Diabetestherapie werden diagnostische und therapeutische Verfahren benötigt. Ziel des Einsatzes innovativer Ansätze ist eine Verbesserung und Erleichterung der Diabetestherapie insgesamt. Hierauf basierend werden verschiedene Technologien vorgestellt.
Einleitung/Definition
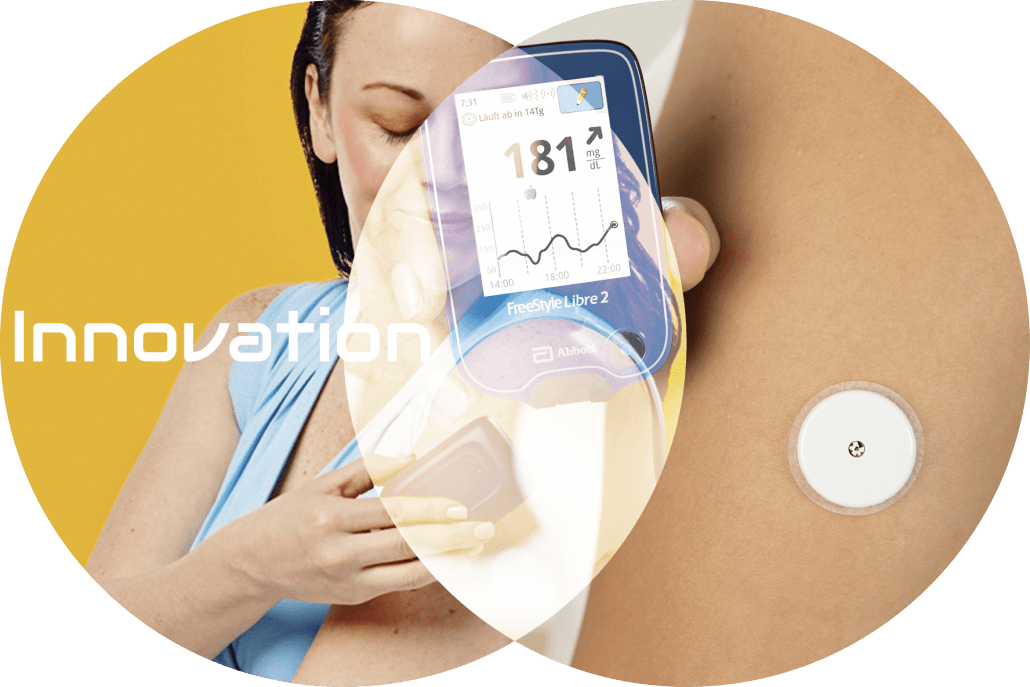
Im Folgenden werden unter dem Begriff „innovativ“ Ansätze verstanden, die noch nicht im breiten klinischen Einsatz, aber in ihrer Entwicklung weit vorangeschritten sind. In unserer schnelllebigen Zeit kommen neue Produktgenerationen in vielen Bereichen in kurzen Zeitabständen auf den Markt; so sind Smartphones oder Autos von vor zwei Jahren bereits „alt“. Es gilt, kritisch zu betrachten, ob alle diese Produkte das Prädikat „innovativ“ verdient haben oder ob sie mehr graduelle Weiterentwicklungen bzw. „Me too“-Produkte sind. Nur wenn innovative Ansätze konkrete Vorteile bei der alltäglichen Diabetestherapie haben, werden sie ernsthaft genutzt. Für den Hersteller, der eine neue Insulinpumpe, ein CGM-System oder eine elektronische Patientenakte auf den Markt bringt, ist damit viel Arbeit, Geld und Energie über Jahre hinweg verbunden. Für die konkrete Patientenbetreuung ergeben sich allerdings in vielen Fällen keine oder nur marginale Verbesserungen. Bahnbrechende Entwicklungen im Bereich der Diabetologie sind eher selten, trotzdem haben wir jüngst erlebt, dass ein technologisches Produkt, das erst vor vier Jahren auf den Markt gekommen ist, inzwischen mehr als eine Million Nutzer weltweit hat (davon > 350 000 allein in Deutschland) – das iscCGM-System (FreeStyle Libre, inzwischen FreeStyle Libre 2, des Unternehmens Abbott).
Für jede moderne Diabetestherapie werden diagnostische und therapeutische Verfahren benötigt. Ziel des Einsatzes innovativer Ansätze ist eine Verbesserung und Erleichterung der Diabetestherapie insgesamt. Basierend auf diesem Ansatz werden im Folgenden verschiedene Technologien vorgestellt. Der Fokus liegt aber nicht auf einzelnen Geräten oder Medikamenten, sondern vielmehr auf der Rolle, die innovative Entwicklungen als Teil der Gesamt-Diabetestherapie haben werden. Dabei kann die Darstellung auch nur andeuten, auf wie vielen und unterschiedlichen Ebenen Diabetes-Technologie bereits heute und zukünftig in die Diabetestherapie eingreift – wird sich doch diese Entwicklung weiter beschleunigen, bedingt durch die Entwicklungen der Informationstechnologie.
Wenn innovative Ideen zu Produkten werden und diese nachweislich durch randomisierte, kontrollierte klinische Studien zur Optimierung der Diabetestherapie von Patienten führen, müssen rasch adäquate Rahmenbedingungen für deren Nutzung geschaffen werden: zum Beispiel die adäquate Kostenerstattung oder die Beschleunigung von Zulassungsprozeduren und Verfahren.
Innovationen müssen bezahlbar bleiben und sollten bei erfolgtem Nutzennachweis für alle Patienten verfügbar sein, auch wenn damit das aufwendige Zulassungsverfahren in Deutschland nicht in Zweifel gezogen wird. Das Bearbeitungstempo sollte jedoch deutlich schneller werden, so dass Innovationen zeitnah in die Hände der Patienten gelangen.
Diagnostische Optionen – Selbstmessung der Blutglukose (SMBG)
Stand der Dinge: Die Messgüte von Messgeräten für die Selbstmessung der Blutglukose (SMBG) hat sich in den letzten Jahren weiter deutlich verbessert. Es gibt Geräte mit Laborqualität – und das bei kleinsten benötigten Blutvolumina, rascher Messung und einfacher Handhabung. Diese Technologie hat sich somit zu einem beachtlichen Reifegrad entwickelt – hier wird aber nicht mehr viel investiert seitens der Hersteller, da die Zukunft in den Systemen für das kontinuierliche Glukosemonitoring (CGM) gesehen wird (s. u.).
Wenn innovative Ideen zu Produkten werden und diese nachweislich zur Optimierung der Diabetestherapie von Patienten führen, müssen rasch adäquate Rahmenbedingungen für deren Nutzung geschaffen werden.
Allerdings verwendet weltweit die überwiegende Anzahl der Patienten mit Typ-2-Diabetes noch die konventionelle Messtechnik für die präprandiale Blutglukosekonzentration. Auch überwiegt der Anteil der Patienten mit Typ-1-Diabetes, die weiterhin SMBG einsetzen, deutlich, was auch daran liegt, dass eine Reihe von CGM-Systemen nach wie vor Blutzuckermessungen zur Kalibrierung benötigen. SMBG wird also nicht verschwinden, auch wenn sich vermutlich die Verhältnisse in den kommenden Jahren weiter zu CGM verschieben werden – getrieben durch immer bessere CGM-Systeme, die zu immer geringeren Kosten verfügbar werden.
Dies gilt für die CGM-Systeme, bei denen die Glukosemesswerte automatisch und direkt an das Empfangsgerät übertragen werden (bei den real-time-CGM-Systemen, rtCGM); dies gilt auch für das iscCGM-System, bei dem die Patienten die gemessenen Glukosewerte durch intermittierendes Scannen (isc) mit dem Lesegerät oder einem Mobiltelefon aus dem Sensor auslesen müssen.
Innovative Ansätze: Deutlich anders sieht es aus, wenn es um die adäquate Dokumentation, Analyse und Nutzung der bei SMBG anfallenden Daten geht. Hier hat eine aktuelle Studie (die ProValue-Studie) belegt, wie durch eine strukturierte und systematische Nutzung der SMBG-Daten durch das behandelnde Diabetesteam und den Patienten eine deutliche Verbesserung in der Glukosekontrolle erreicht werden kann. Dies ist auch ein Beleg dafür, was durch den Einsatz von digitalen Tools und eine „smarte“ Datennutzung bei Patienten mit Typ-2-Diabetes mit einer Insulintherapie erreicht werden kann.
Der Einsatz von Apps zur Dokumentation und Analyse von SMBG-Daten, die automatisch vom Messgerät an das Smartphone übertragen werden, führt ebenfalls zu einer nachweislichen Verbesserung der Glukosekontrolle. Durch Nutzung weiterer Informationen zu Diabetesmanagement und Patientenverhalten sind weitere Verbesserungen bei dieser beachtlich großen Patientengruppe zu erwarten. So liefern zum Beispiel Smartpens (s. u.) wichtige Hinweise zur Insulintherapie der Patienten: Wurde zum Beispiel eine adäquate Dosis im Verhältnis zur gemessenen Glukosekonzentration appliziert? Geschah dies zum richtigen Zeitpunkt? Smartphones und Fitnesstracker liefern weitere therapeutisch relevante Informationen zum Bewegungsverhalten.
Wenn all diese Daten in die Cloud hochgeladen werden, kann durch geeignete Algorithmen der Regelkreis auch bei diesen Patienten geschlossen werden, und sie erhalten eindeutige Angaben dazu, wie viel Insulin sie zu welchem Zeitpunkt spritzen sollen. Was in dem Zusammenhang noch fehlt, sind zuverlässige Angaben zum Kohlenhydratgehalt der Mahlzeiten. Hier wird seit Jahren an verschiedenen Ansätzen gearbeitet, um zum Beispiel durch Auswertung von Fotos des Essens rasch eine Abschätzung des Kohlenhydratgehalts zu erreichen. Eine wirklich praxistaugliche Lösung gibt es aber noch nicht.
Was gilt es zu tun? Durch die geschickte Nutzung von SMBG-Daten, die mit qualitativ hochwertigen Geräten erhalten werden, kann bei einer Vielzahl von Patienten eine deutliche Verbesserung in der Diabetestherapie erreicht werden. Das Mehr an Informationen zum Glukoseverlauf, wie es durch CGM-Systeme geliefert wird, ist vermutlich nicht für alle Patienten(gruppen) wirklich notwendig. Offenheit zu einer differenzierten Nutzung der SMBG-Daten und die Weiterentwicklung der genannten Themenkomplexe könnten für viele Patienten einen erheblichen Nutzen bieten, und dies bei moderaten Kosten.
Diagnostische Optionen – kontinuierliche Glukosemessung (CGM)
Stand der Dinge: Als vor etwa 20 Jahren die ersten CGM-Systeme auf den Markt kamen, waren sich die Experten darüber einig, dass diese die Diabetestherapie revolutionieren werden und dass in wenigen Jahren alle Patienten solche Systeme ständig nutzen würden. Dies ist eindeutig nicht passiert: Aktuell gibt es schätzungsweise 40 000 CGM-Dauernutzer in Deutschland (bezogen auf Patienten mit Typ-1-Diabetes und rtCGM-Systemen), auch wenn – nach jahrelangem Prozess – der Gemeinsame Bundesausschuss (G-BA) durch den Beschluss für die Kostenerstattung von rtCGM-Systemen den Zugang zu diesen deutlich erleichtert. Im Alltag gibt es allerdings immer noch Hürden, abhängig von der jeweiligen Krankenversicherung und dem Medizinischen Dienst. Ein weiterer wichtiger Schritt war, dass Therapieentscheidungen aus regulatorischer Sicht auf den Messergebnissen von CGM-Systemen beruhen dürfen; das gilt jedoch derzeit nicht für alle CGM-Systeme.
Als vor 20 Jahren die ersten CGM-Systeme auf den Markt kamen, waren sich die Experten darüber einig, dass in wenigen Jahren alle Patienten solche Systeme ständig nutzen würden.
Neben den klassischen rtCGM-Systemen, bei denen der Sensor alle 6 bis 10 Tage gewechselt wird und der die Glukosekonzentration in der interstitiellen Gewebeflüssigkeit misst, steht nun ein rtCGM-System zur Verfügung, bei dem der Sensor unter die Haut implantiert wird und 180 Tage genutzt werden kann, bevor er ausgetauscht werden muss. Bis auf ein rtCGM-System müssen alle ein- bis zweimal täglich mit einer Blutglukosemessung kalibriert werden, um Blutglukosewerte und interstitielle Glukosewerte aufeinander abzustimmen.
Auch beim bisher einzig verfügbaren System für intermittent scanning CGM (iscCGM) wird die Glukosekonzentration wie bei den rtCGM-Systemen in der interstitiellen Flüssigkeit gemessen, kalibriert werden muss dieses System nicht. Von der therapeutischen Nutzung her wird es wegen der einfachen Nutzung vielfach als SMBG-Ersatz genutzt. Die zweite Generation bietet, im Gegensatz zur ersten, automatische Alarme beim Erreichen von definierten Glukosewerten, wie dies bei rtCGM-Systemen der Fall ist. Weil die Kosten des iscCGM-Systems niedriger sind als die von rtCGM-Systemen, übernehmen die meisten Krankenversicherungen die Kosten dafür. Das iscCGM-System wird weltweit von mehr als 1 Mio. Patienten genutzt und ist damit mit Abstand das am meisten genutzte CGM-System.
Innovative Ansätze: Praktisch jeder der Hersteller von CGM-Systemen bietet in mehr oder weniger kurzen Zeitabständen neue Generationen seiner Systeme an. Dabei steigt nicht nur die analytische Güte dieser Systeme deutlich an, auch konnte die Empfindlichkeit der Glukosesensoren in Hinsicht auf Interferenzen mit bestimmten Medikamenten massiv reduziert werden. Weiterhin haben manche CGM-Systeme nun „Konnektivität“, d. h. die Messwerte können automatisch an Familienangehörige oder an das Diabetesteam übermittelt werden, falls dies gewünscht wird.
Parallel zu diesen Verbesserungen der bisherigen CGM-Systeme wird an einer Vielzahl innovativer Ansätze gearbeitet, um Nachteile der bisherigen CGM-Systeme auszugleichen und die Kosten zu reduzieren. Beim aktuellen Kostenniveau können schlichtweg nicht alle Patienten mit Diabetes die CGM-Systeme nutzen – dies würde das Gesundheitssystem überfordern. Angestrebt werden deshalb Preisniveaus, wie sie für SMBG gelten. Weiterhin gilt es, die Größe der Systeme (insbesondere des Glukosesensors) weiter zu reduzieren, damit die Messung noch diskreter erfolgen kann. Dadurch können auch die Inserter, mit denen die Glukosesensoren appliziert werden, kleiner gehalten werden, was bei manchen Produkten zu weniger Plastikmüll führt.
Da bei dauerhafter Nutzung von CGM-Systemen (auch bei anderen Diabetestechnologien wie Insulinpumpen) bestimmte Substanzen in den verwendeten Pflastern/Kunststoffgehäusen zu ernsthaften Hautreizungen führen können, gilt es auch hierbei, neue Lösungen zu finden. Die bei einem gewissen Prozentsatz der Patienten auftretenden ausgeprägten Allergien verhindern teilweise die Nutzung solcher technischer Optionen. Durch die Verwendung von Pflastern, die auf Silikonbasis funktionieren, sind hier hoffentlich Verbesserungen möglich, auch wenn diese mit höheren Kosten einhergehen.
Was gilt es zu tun? Eine ernsthafte Schwäche der CGM-Systeme ist, dass es für diese bisher keine Standards gibt wie für SMBG-Geräte. Erste Ansätze zur Beurteilung der Messgüte werden aktuell diskutiert, die fehlende Standardisierung erschwert jedoch den Einsatz von CGM-Systemen im Krankenhaus: Hier dürfen nur qualitätsgesicherte Messmethoden eingesetzt werden.
Die amerikanische Gesundheitsbehörde hat kürzlich durch Einführung einer „i“-Markierung einen Schritt Richtung Standardisierung getan. Dabei steht i für Interoperabilität, d. h. für einen problemlosen Datentransfer und -austausch zwischen verschiedenen Diabetestechnologien. Durch diesen Schritt soll die Verknüpfbarkeit der Geräte verschiedener Hersteller wesentlich verbessert werden.
Therapeutische Optionen – Pens/Smartpens
Stand der Dinge: In Deutschland verwendet heutzutage die Mehrzahl der Patienten „Insulinstifte“ für die Insulininjektion, und nicht mehr Spritzen. Die Handhabung solcher Pens ist über die Zeit hinweg deutlich einfacher und sicherer geworden. Durch die Entwicklung besserer Kanülen erfolgt die Insulininjektion heutzutage in den meisten Fällen praktisch schmerzfrei, was einen wesentlichen Fortschritt darstellt.
Eine ernsthafte Schwäche der CGM-Systeme ist, dass es (im Vergleich zu den Geräten für SMBG) für diese bisher keine Standards gibt wie bei SMBG-Geräten.
Innovative Ansätze: Was bei Pens bisher im größeren Maßstab fehlt, ist deren Anbindung an die digitale Welt: die automatische Erfassung der applizierten Insulindosis und des Zeitpunkts der Injektion sowie der Transfer dieser Daten an eine Stelle, wo diese Informationen (zusammen mit anderen Daten des jeweiligen Patienten) zusammenlaufen und geeignet ausgewertet werden. Die Verfügbarkeit dieser wichtigen Informationen zur praktischen Insulintherapie kann – zusammen mit Informationen zum Glukoseverlauf – genutzt werden, um klare Hinweise zur Insulintherapie zu geben und Fehler zu vermeiden. Dies sollte zu einer weiteren Optimierung der Diabetestherapie führen. Schwierigkeiten macht dabei wohl die zuverlässige Messung der noch im Insulinreservoir verbleibenden Insulinmenge.
Was gilt es zu tun? Wie bei vielen anderen Diabetestechnologien auch, wäre die Durchführung einer Evaluierung der Eigenschaften von Insulinpens durch eine unabhängige Institution eine wesentliche Hilfe. Wenn dadurch konkrete Hinweise für die Auswahl der Pens im Sinne einer Positivliste geliefert würden, wäre dies für Patienten wie auch für die Diabetesteams hilfreich. Die Frage ist: Wer bezahlt solche Evaluierungen? Diese würden idealerweise mit einem Kopf-an-Kopf-Studiendesign durchgeführt, um eine gute Beurteilungsmöglichkeit zu etablieren.
Therapeutische Optionen – Insulinpumpen/Patch-Pumpen
Stand der Dinge: Moderne Insulinpumpen sind kleine, leicht zu bedienende und zuverlässige Geräte mit diversen Funktionen, um eine näherungsweise physiologische Insulintherapie zu erreichen. Der technologische Fortschritt bei Insulinpumpen ist eng mit dem Fortschritt in anderen Bereichen verbunden, zum Beispiel mit der Entwicklung kleinerer Pumpenmotoren oder Computer-Prozessoren mit mehr Rechenleistung, Displays mit guter Lesbarkeit und leichten Batterien mit hoher Leistung. Im Vergleich zu den Pumpen hat es bei den Insulin-Infusionssets eher wenig Entwicklung gegeben, diese stellen im Alltag der Patienten immer noch eine erhebliche Hürde für die erfolgreiche Nutzung dieser Therapieform dar. Bei den Patch-Pumpen sind Infusionskanüle und Schlauch, der das Reservoir mit der Kanüle verbindet, in die Pumpe integriert und damit für die Patienten nicht sichtbar. Bisher ist nur eine solche Patch-Pumpe auf dem Markt. Diese wird insbesondere von Patienten genutzt, die vorher keine konventionelle Insulinpumpe verwendet haben.
Eine von Patienten viel genutzte Option sind Bolusrechner, die in Insulinpumpen (oder Blutglukose-Messsystemen) integriert sind; diese erleichtern unter Verwendung verschiedener Algorithmen die Berechnung der Insulindosis für die jeweilige Mahlzeit auf Basis des aktuellen Blutzuckerwerts, des Blutzuckerzielwerts, der tageszeitabhängigen Insulinempfindlichkeit und der noch wirksamen Menge an vorher appliziertem Insulin. Eine Standardisierung der in dem Zusammenhang verwendeten Begriffe und Handhabungsschritte würde die Nutzung dieser Kalkulatoren nicht nur einfacher machen, sie würde auch das Risiko von Fehlbedienungen reduzieren.
Innovative Ansätze: Während es bei der Größe und Form konventioneller Insulinpumpen in den letzten Jahren keine großen Änderungen gegeben hat – auch aus technischen Gründen (wie Insulinpatronen und Bedienbarkeit) –, gibt es eine Reihe unterschiedlicher Patch-Pumpen-Konzepte. Von diesen sollen nun die ersten auf den Markt kommen; dabei stellt die zuverlässige Herstellung solcher Pumpen in größerem Maßstab eine ernsthafte Herausforderung dar. Durch die Entwicklung von Insulinreservoirs mit einer anderen Form sowie anderen Pumpenkonzepten können die Pumpen auch anders gestaltet werden.
Es gibt Ansätze, bei denen durch „Microneedles“ das Insulin schmerzfrei in die oberen Hautschichten appliziert und dort rasch resorbiert wird. Bei einigen Ansätzen wird durch eine damit gekoppelte Glukosemessung eine unmittelbare Steuerung der Insulingabe bewirkt; dies ermöglicht eine „automatische“ Insulintherapie ohne Intervention der Patienten.
Im gleichen Ansatz gibt es Insuline, die als Depot in das subkutane Gewebe appliziert werden und dort entsprechend der vorherrschenden Glukosekonzentration freigesetzt werden („Smart-Insuline“). Vergleichbar dazu gibt es Bemühungen, ein Insulin zu entwickeln, das an ein lichtempfindliches Molekül gekoppelt ist: Durch Einstrahlung von einer gewissen Menge Licht einer definierten Wellenlänge soll das Insulin dann entsprechend dem aktuellen Bedarf freigesetzt werden.
Was gilt es zu tun? Wenn neue Ansätze zur Insulinapplikation auf den Markt kommen, gilt es, deren Sicherheit und klinische Effizienz in klinischen Studien zu evaluieren. Bisher waren solche Studien vielfach darauf ausgerichtet, die (vermuteten) Vorteile der neuen Geräte möglichst gut herauszuarbeiten und weniger zu evaluieren, was deren konkrete Vorteile im Alltag wirklich sind. Durch die Verschärfungen bei den Vorgaben für die CE-Kennzeichnung sowie durch Health-Technology-Assessments (HTAs) werden die Hürden für eine Markteinführung und für die Kostenerstattung neuer Medizinprodukte erhöht. Dazu kommen Evaluierungen zur Handhab- und Einsetzbarkeit solcher Produkte im Alltag durch die Anwender. Die Hürden für die Hersteller werden dadurch insgesamt höher. Die Hoffnung ist, dass dies nicht zu einer Blockierung von Innovationen führt (auch durch damit verbundene höhere Kosten), sondern zu einer qualitativen Verbesserung bei einer erhöhten Sicherheit. Hier gilt es, eine bessere Zusammenarbeit zwischen allen interessierten Gruppen zu etablieren.
Systeme zur automatisierten Insulin-Dosierung (AID)
Stand der Dinge: Bei diesen Systemen erfolgt eine „Verschmelzung“ diagnostischer und therapeutischer Optionen; fortwährend wird die Insulininfusion über eine Pumpe auf Grundlage von durch CGM-Systeme kontinuierlich gemessenen Glukosewerten angepasst. Weil die adaptive Insulinzufuhr bei dem ersten auf dem Markt verfügbaren AID-System (dem System MiniMed 670G von Medtronic) nur die basale Insulininfusion betrifft, die Patienten die Insulinboli zu den Mahlzeiten aber weiterhin manuell abrufen müssen, spricht man hierbei von einem „Hybrid-AID-System“.
Innovative Ansätze: Es sind eine ganze Reihe von AID-Systemen in der klinischen Entwicklung, bei denen die Insulinzufuhr vollständig übernommen wird, auch bei den Mahlzeiten. Bei den „bi-hormonellen Ansätzen“ wird nicht nur Insulin infundiert, sondern auch Glukagon. Durch diesen „Gegenspieler“ des Insulins kann bei Gabe von zu viel Insulin eine drohende Hypoglykämie vermieden werden. Mehr AID-Systeme unterschiedlicher Ausprägung werden in den nächsten Jahren verfügbar werden; sie ermöglichen eine „technische Heilung“ des Diabetes – und die Patienten brauchen sich nicht mehr um ihre Insulintherapie zu kümmern. Dabei kann keine völlige Normalisierung der Glukosekontrolle erreicht werden, da die Insulingabe immer noch subkutan erfolgt und nicht direkt in die Pfortader. Im Idealfall (bei dauerhaft zuverlässiger Funktion aller Komponenten) ermöglichen es solche Systeme trotzdem den Patienten, ein weitgehend normales Leben zu führen – ohne Angst vor akuten Stoffwechselentgleisungen oder diabetesbedingten Komplikationen haben zu müssen. Neben den rein medizinischen Aspekten gilt es, die ausgeprägten positiven psychologischen Aspekte für die Patienten und deren Angehörige zu sehen, die mit dem Einsatz solcher Systeme verbunden sind.
Was gilt es zu tun? Es ist noch nicht klar, wie hoch die Kosten sind, die mit dem Einsatz von AID-Systemen verbunden sein werden. Die Kosten für die MiniMed 670G liegen wohl nicht über denen von Insulinpumpen, die eine Kommunikation mit einem rtCGM-System haben. Trotzdem gilt es, die Frage zu klären, wie viele Patienten solch ein System nutzen wollen und welche Kosten die Gesundheitssysteme tragen können. Aktuell ist nicht klar, ob die gesetzlichen Krankenversicherungen die Kosten für dieses System übernehmen. Dies hat auch mit der Notwendigkeit der Listung im Hilfsmittelverzeichnis zu tun, und es soll eine neue Listung für AID-Systeme geben.
Für die erfolgreiche und sichere Nutzung von AID-Systemen müssen die Nutzer eine adäquate Schulung erhalten, die sich nicht nur auf deren Handhabung und technische Aspekte bezieht. Sie muss die Nutzer auch befähigen, im Fall von Ausfällen des Systems adäquat zu reagieren.
Patienten können mit Hilfe von Bauanleitungen aus dem Internet (und dort herunterladbaren Algorithmen) AID-Systeme selbst bauen. Die „Looper“ erreichen damit eine beachtlich gute Stoffwechselkontrolle, allerdings stellen solche Systeme keine zugelassenen Medizinprodukte dar, weshalb die Hersteller dafür keine Haftung übernehmen.
Elektronische Patientenakten
Stand der Dinge: Von einem generellen Standpunkt aus betrachtet ist dieses Thema ein absolutes Trauerspiel! Es hat zwar in Deutschland mehrere Anläufe gegeben, die Daten möglichst vieler Patienten mit Diabetes in einer geeigneten elektronischen Patientenakte zu erfassen, allerdings haben sich diese bisher nicht wirklich etablieren und durchsetzen können.
Gleichzeitig gilt es zu sehen, wie erfolgreich (beurteilt nach der Anzahl relevanter nationaler und internationaler Publikationen) ein deutsches Register für Kinder und Jugendliche ist: Im „DPV“ (Diabetes-Patienten-Verlaufsdokumentation) werden Daten zu praktisch allen solchen Patienten gesammelt und regelmäßig analysiert.
Innovative Ansätze: In den USA sind elektronische Patientenakten heute vorgeschrieben. Es gibt dort eine ganze Reihe von Ansätzen, die so verfügbaren Daten geeignet zu aggregieren und auszuwerten. In Deutschland werden die Daten von Patienten mit Diabetes auch in unterschiedlichsten Hard- und Softwaresystemen erfasst, leider ist es aber – insbesondere aus Datenschutzgründen – extrem schwierig, diese Daten in einer sinnvollen Weise zu aggregieren.
Was gilt es zu tun? Es wäre wichtig zu verstehen, warum die bisherigen Ansätze nicht funktioniert haben. Was sind die „Roadblocks“ in unserem Gesundheitssystem dafür? In anderen Ländern wie Schweden gibt es schon seit vielen Jahren ein erfolgreiches Diabetesregister. Wenn die Datenerfassung mit irgendwelchen zusätzlichen Aktivitäten verknüpft ist, die über das sowieso schon vorgegebene Ausmaß hinausgehen, dann wird dies in der Praxis nur dann auf Dauer erfolgreich sein, wenn die notwendige Finanzierung etabliert werden kann. Gleichzeitig werden die Daten von einer Vielzahl aller Patienten mit Diabetes in den Disease-Management-Programmen (DMPs) gesammelt. Diese Daten können aber nicht mit anderen Daten zusammengeführt und sinnvoll ausgewertet werden; dies ist eine nicht nachvollziehbare Verschwendung. Vor diesem Hintergrund ist es interessant zu sehen, dass die Deutsche Diabetes Gesellschaft (DDG) die Einführung einer elektronischen Diabetes-Akte plant. Es gibt eine von der DDG getragene Initiative zur Errichtung eines AID-Registers. Darin sollen über einen gewissen Zeitraum alle relevanten Informationen bei Nutzung von AID-Systemen gesammelt werden, auch um zu evaluieren, welche Patienten solche Systeme bekommen und wie erfolgreich deren Nutzung ist.
Mehr AID-Systeme werden in den nächsten Jahren verfügbar werden; sie ermöglichen eine „technische Heilung“ des Diabetes – und die Patienten brauchen sich nicht mehr um ihre Insulintherapie zu kümmern.
Digitalisierung/Telemedizin
Stand der Dinge: Bei allen Aspekten der Behandlung von Patienten mit Diabetes fallen Daten an – deshalb kann Diabetes als eine „Daten-Management-Erkrankung“ betrachtet werden. Daten und deren Handhabung in jedweder Form werden zukünftig einen ständig zunehmenden Einfluss auf die Diabetestherapie haben und damit eine „datenbasierte Diabetologie“ ermöglichen. Die Frage ist: Wie werden die Daten erfasst und was passiert mit diesen? Bisher liegt das Schwergewicht des Denkens auf dem Erfassen der Daten, d. h. die Daten in geeigneter und sicherer Form von den jeweils genutzten Geräten herunterzuladen und in Computern zu speichern. Dabei ist dies nur der notwendige erste Schritt: Im nächsten Schritt müssen wir zu einer intelligenten Gesamtbetrachtung und Analyse aller Daten kommen – durch eine Zusammenfassung aller verfügbaren Angaben zum jeweiligen Patienten, die auch Angaben zu Körpergewicht, Essverhalten, medikamentöser Therapie etc. beinhalten sowie zu dessen anderen Aktivitäten wie Bewegung, Sport etc. Patienten nutzen Apps in ihren Smartphones, um die bei ihrer Therapie anfallenden Daten zu dokumentieren und sich Unterstützung zum Beispiel bei der Bolus-Berechnung bei einer Mahlzeit zu holen.
Wenn es um die Betreuung von Patienten geht, die entweder in größerer Entfernung von einer adäquaten Behandlungsmöglichkeit wohnen oder die nicht mehr mobil sind, ist Telemedizin eine interessante Option. Schaut man sich die Aktivitäten der großen Hardware- und Softwarekonzerne für den Gesundheitsbereich an, dann wird klar, dass diese in Telemedizin eine attraktive Option für die Patientenbetreuung in der Zukunft sehen („Doc on demand“). Allerdings spielt bisher die Telemedizin in der praktischen Diabetologie in Deutschland nur eine untergeordnete Rolle – anders als bei chronischen Hochrisikoerkrankungen wie Herzinsuffizienz oder bei Akutereignissen (Myokardinfarkt, Schlaganfall). Dies hat mit der recht hohen Dichte an Diabetologen in weiten Gebieten Deutschlands zu tun, andererseits aber auch mit Defiziten bezüglich gesetzlicher Regelungen und vor allem mit der nicht adäquaten Honorierung.
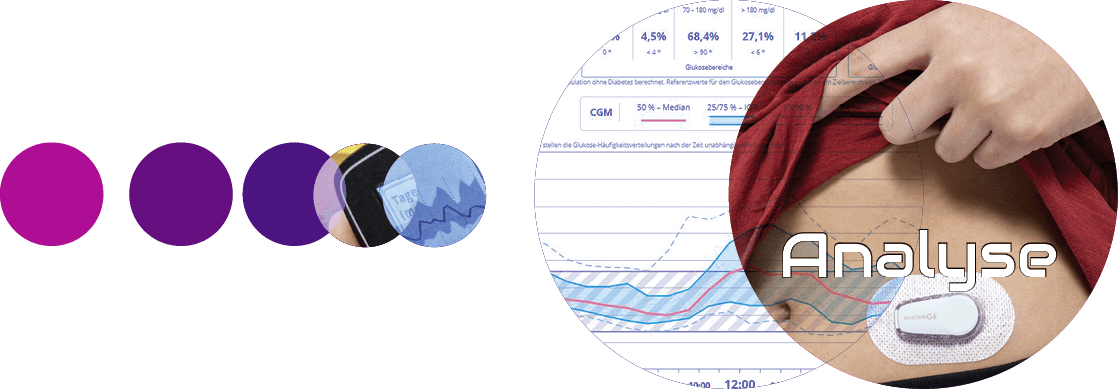
Innovative Ansätze: Idealerweise werden die Daten von den entsprechenden Geräten automatisch (d. h. ohne aktives Zutun der Patienten oder Ärzte) heruntergeladen, an entsprechenden sicheren Stellen gespeichert und analysiert. Für solche Analysen und Interpretationen werden Algorithmen in Form von „Clinical Decision Support Systems“ (CDSS) genutzt. Diese sollen beispielsweise Muster erkennen und Vorschläge für Therapieanpassungen machen. Die bisher am weitesten verbreitete Anwendung ist die Auswertung von Blutzuckerprofilen. Die Programme von verschiedenen Anbietern (wie die Hersteller der jeweiligen Produkte) ermöglichen dem Diabetesteam eine rasche Analyse der in den Blutglukosemesssystemen gespeicherten Messwerte; von diesen fallen zwischen zwei Arztbesuchen und bei 4 bis 5 Blutzuckermessungen pro Tag einige Hundert an. Bei der Auswertung gespeicherter CGM-Profile handelt es sich um die Analyse von ca. 25 000 Messwerten, die in einem Zeitraum von drei Monaten anfallen.
Expertensystemen gehört die Zukunft, vor allem wegen des immer massiver werdenden Zeitdrucks der Therapeuten – denn es gibt immer mehr Patienten bei immer weniger Diabetologen.
Die derzeitig verfügbaren Softwarelösungen sind keine „Expertensysteme“, welche den Ärzten und den Patienten konkrete Hinweise zur Therapie-Adjustierung geben – sie liefern primär eine deskriptive Analyse dieser Daten. Expertensystemen gehört die Zukunft, vor allem wegen des immer massiver werdenden Zeitdrucks der Therapeuten – denn es gibt immer mehr Patienten bei immer weniger Diabetologen. Damit der persönliche Kontakt der Patienten mit ihrem Arzt nicht noch kürzer wird, sind schnelle und die Arbeit des Diabetesteams konkret unterstützende Softwarelösungen essenziell.
Was gilt es zu tun? Moderne (digitale) Technologien müssen im größeren Gesamtkontext bei Diabetes gesehen werden. Hierbei gilt es, die Vorgaben, Leitlinien etc. der medizinischen Fachgesellschaft zu berücksichtigen, aber auch Medikamenteninformationen etc. Durch die Berücksichtigung der Daten von quasi unendlich vielen anderen Patienten, deren Informationen in entsprechenden Datenbanken vorliegen, können solche Systeme Patienten sehr umfassend betreuen. Die Diabetologie sollte – wie dies beispielsweise bei der Evaluierung von Apps in Deutschland passiert – diese Entwicklungen nicht „Fachfremden“ überlassen, sondern sich federführend an diesen beteiligen bzw. dies überwachen und kontrollieren. Wenn es zum Beispiel Angebote für „Doc on demand“ gibt, also ärztliche Konsultationen über das Internet zu einem von den Patienten gewünschten Zeitpunkt: Wie ist sichergestellt, dass diese Behandlung adäquat erfolgt? Vor allem, wenn kein Zugriff auf die Daten der Patienten möglich ist?
Telemedizinische Ansätze werden sich nur dann nachhaltig etablieren, wenn es gelingt, in entsprechenden Studien zu zeigen, dass der Einsatz von Telemedizin zu einer deutlichen Einsparung von Zeit und Kosten führt – bei gleichzeitig adäquater Betreuung der Patienten. Aktuell gibt es eine Reihe telemedizinischer Projekte im Bereich Diabetes in Deutschland – auch eines mit Kindern in Schleswig-Holstein, das vom Innovationsfonds finanziert wird.
Zukunft
Bei der Beschreibung der „Schönen Neuen Welt“ gilt es, die Schwierigkeiten und Hürden für die Implementierung in die Praxis zu sehen. Während die Implementierung von Smartphones (aber auch des iscCGM-Systems) innerhalb weniger Jahre erfolgte, haben sich die regulatorischen Systeme (für die Zulassung von Medizinprodukten/Medikamenten) wenig bewegt … und die Kostenerstattung noch weniger. Dies kann einerseits als notwendige Zurückhaltung betrachtet werden, da nicht jede „Innovation“ einen wirklichen Fortschritt für die Patienten bringt. Gleichzeitig kann dies auch als eine Blockade oder unzumutbare Verzögerung betrachtet werden. In diesem Spannungsfeld gilt es, die Balance zu finden zwischen der raschen und richtigen Implementierung „richtiger“ Innovationen versus der überhasteten Nutzung von Scheininnovationen.
Insbesondere die notwendigen Aktivitäten – wie bei den Rahmenbedingungen – rufen nach einem koordinierten und strukturierten Herangehen der Arbeitsgemeinschaft Diabetes & Technologie (AGDT) und der DDG, um diesen Rechnung zu tragen. Dabei stellt sich die Frage, ob Arbeitsgemeinschaften eine geeignete Struktur und Finanzierung aufweisen, um solche Aufgaben gut und zeitnah handhaben zu können.
Autor:
Prof. Dr. Lutz Heinemann
Science-Consulting in Diabetes GmbH, Geulenstraße 50, 41462 Neuss